跑蛋白胶实验操作
实验步骤
- 检漏
制胶前先用水检查是否漏液,等15-20 min 液面无明显下降即可进行制胶。 - 制备和灌注分离胶:
制胶前先捡漏
制备分离胶需要两块玻璃板,一个短板,一个长板,将两块玻璃板夹在制胶架上,灌胶完成后,加异丙醇赶走凝胶上面的气泡。关于灌胶的高度,这可以通过放置梳子确定,一般大约 梳子下1cm ,用笔标记制胶的高度,开始灌胶,加异丙醇封胶。等待胶凝固后,倒掉上层异丙醇,用滤纸吸干异丙醇。 - 制备和灌注浓缩胶:
当下层的分离胶凝固后,就可以开始直接加浓缩胶至玻璃最上层,然后插入梳子。 - 点样至凝胶孔中:
浓缩胶凝固后,将胶板放入缓冲液中,拔出梳子。
用微量移液器向凝胶孔中依次加入蛋白marker和样本,蛋白marker是已知蛋白条带分子量的预染蛋白,可作为标定蛋白大小的标尺参考。然后依次点入其他样本至凝胶孔中。每孔的样本上样量保持一致(主要是质量一致),加样时要小心,确保不损坏加样孔的尺寸或不将样品溢出孔外,更不能把样本加到孔外。 在这个阶段,蛋白质的样品是蓝色的,因为在制备样品时使用了电泳指示剂染料–溴酚蓝 - 设定电泳条件,启动电泳:
将凝胶和玻璃板浸入电泳缓冲液中后,就可以开始设定电压 80 V 和时间,开始电泳了。 当示踪染料到达或穿过凝胶时,停止电泳。 - 分析蛋白条带
- 考马斯亮蓝染色
- 将跑完的胶取出放入双蒸水中,微波炉加热至沸腾。
- 将双蒸水倒出,加入考马斯亮蓝染色液(50x),沸腾后保持30s~1min。
- 放入摇床 20 ℃ 50 r 30 min。
- 将染色液收集循环使用(循环两次,一星期内,4℃)
- 加入双蒸水,加热沸腾并保持沸腾状态30 s - 1 min.
- 重新进入摇床脱色。(脱色时间看效果而定)
WB
WB(Western blot),即免疫印迹(immunoblotting),是一项在分子生物学、生物化学、免疫学等领域中应用非常广泛的技术。这一技术利用抗体与组织或细胞样品中特定蛋白的特异性结合作用,根据条带的位置和强弱实现蛋白鉴定和表达分析。常用的WB显色方法是ECL化学发光法。
WB流程
首先通过SDS-PAGE聚丙烯酰胺凝胶电泳使蛋白质样本分离,再将凝胶上的蛋白电泳转移到固相载体上(NC膜或者PVDF膜),方便后续印迹显影操作,然后使用封闭液将封闭非特异位点,以避免抗体的非特异性吸附,这样固定的蛋白质即可与特异性的多克隆或单克隆抗体相互作用。最后通过化学发光法或荧光方法进行蛋白条带显影。
SDS-PAGE
SDS-PAGE(十二烷基硫酸钠–聚丙烯酰胺,sodium dodecyl sulfate – polyacrylamide gel electrophoresis)凝胶电泳是一种可以根据蛋白质的分子量分离样本中蛋白的技术。在电荷的影响下分离大分子称为电泳(electrophoresis)。在SDS-PAGE中使用的凝胶是聚丙烯酰胺(polyacrylamide),使蛋白质呈线性化的试剂是SDS。 因此得名SDS-PAGE。
原理
首先准备一套蛋白电泳设备,蛋白质样品和marker上样到凝胶孔中,设置电压,启动电泳程序。
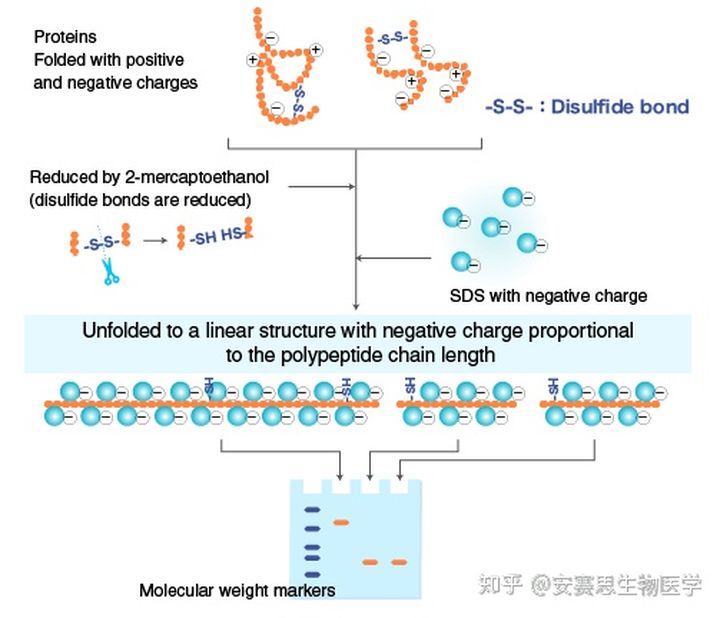
通常样本中会添加一种还原剂,如 巯基乙醇 或二硫苏糖醇(DTT)(在洗涤剂的存在下,如SDS),可以打开折叠蛋白质的二硫键;而样本中加入的SDS洗涤剂可以给所有蛋白质加上负电荷,从而将它们线性化成多肽。聚丙烯酰胺则是多肽电泳分离的介质。多肽在电场的作用下向阳极方向泳动。
蛋白电泳的迁移率与以下三个因素有关:
-
形状—所有的蛋白质在用还原剂处理后都处于 一级结构 中。 因此,形状不影响蛋白质的分离。
-
电荷—经过SDS处理后,所有的蛋白质都是 负电荷 , 因此,电荷不影响分离。
-
大小—蛋白质的分离完全与它们的 分子量大小 有关。
在电泳中,分子量越小的多肽移动得越快,因为它们遇到的阻力更小。分子量越大的多肽移动得更慢,因为它们遇到的阻力更大。因此蛋白质完全是因为分子量大小的不同而分开。
试剂作用
-
β-巯基乙醇/二硫苏糖醇(DTT)
β-巯基乙醇或二硫苏糖醇(DTT)做为还原剂添加入样品中,可以还原(分解)存在于蛋白质的肽链上半胱氨酸残基之间的二硫键(S-S键)。 S-S键使蛋白质折叠形成二级结构 。因为蛋白的构象会干扰电泳的迁移率。所以,当电泳时,消除蛋白构象对迁移率的干扰非常重要。β-巯基乙醇还原蛋白的二硫键为游离的-SH,样本中所有的蛋白都变成线性的一级结构,使其电泳迁移率只与蛋白分子量有关。 -
十二烷基硫酸钠 (SDS)
在制备SDS-PAGE样品时,将SDS混合在样品缓冲液中。 蛋白样本用β-巯基乙醇处理后解聚成单一线性;用SDS处理后,所有蛋白质均只带负电荷。 SDS可以使所有的蛋白质分子均匀的带上负电荷(图01)。 因此,当施加电压时,所有的蛋白质都向凝胶的正极迁移。 因为,不同大小的蛋白质得到的负电荷与其分子量成正比,它们只因为分子量大小的不同而分离开,而不是因为带电荷的多少或者蛋白构象。 在凝胶中也存在SDS,这是为了确保所有的蛋白质在整个凝胶中保持荷载负电荷。 -
溴酚蓝 (BPB)
溴酚蓝是电泳中的示踪染料,用于监测各个蛋白分子电泳过程的进展。 BPB与样品蛋白混合后上样,当电泳开始时,BPB与蛋白质一起迁移,但速度更快,会比样品中的任何蛋白质更快到达凝胶的末端,甚至缓冲液中的甘氨酸分子也在BPB之后到达末端。 BPB带有轻微的负电荷,这就是为什么它可以向阳极迁移,同时又可以作为蛋白质分子的示踪染料。 -
聚丙烯酰胺凝胶
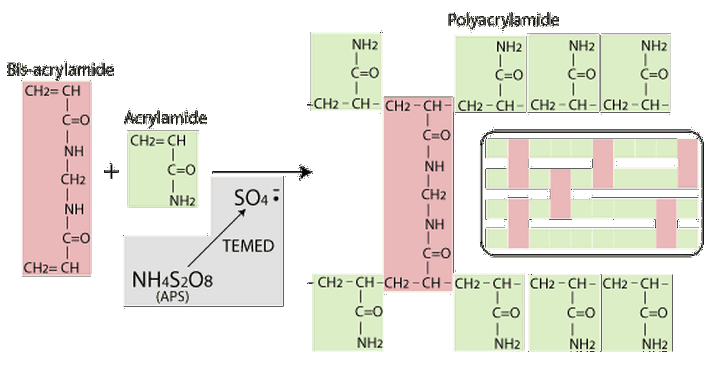
聚丙烯酰胺凝胶是通过使用少量的交联剂(如N,N‘-亚甲基双丙烯酰胺)使单体丙烯酰胺在水中的聚合而成。因此,丙烯酰胺(Acrylamide)和双丙烯酰胺(Bis-acrylamide)共聚形成了丙烯酰胺的直链与双丙烯酰胺的相互联结形成三维网络结构。
凝胶的聚合是通过自由基机制发生的. TEMED(N,N,N,N-四甲基乙二胺)作为催化剂,生成硫酸盐自由基。过硫酸铵是提供形成自由基的硫酸盐基团的。 这些用于自由基生成的硫酸盐由过硫酸铵提供。
浓缩胶工作原理
浓缩胶的目的是将需要分离的蛋白质混合物聚集在浓缩胶和分离胶的分界线上。 因此,所有的蛋白质首先被压缩累积在分界线上,然后,在大约同一时间进入分离凝胶,无论蛋白质的大小是多少.
2种分子与此有关:
- 紧随其后的来自Tris-Gly电泳缓冲液的甘氨酸分子
- 具备牵引作用的来自Tris-HCL 电泳缓冲液的氯化物离子
当施加电压后,甘氨酸分子(最简单的氨基酸)和Cl-开始通过凝胶向正极迁移。 由于甘氨酸分子在浓缩胶中以两性离子的形式存在,其电泳迁移速率非常慢。 氯离子比甘氨酸分子迁移得更快,产生了不平衡的正反离子区域,从而在氯离子和甘氨酸离子之间形成了很大的电压梯度。 在甘氨酸分子(最慢的)和氯离子(最快的)之间存在样本混合物中的所有蛋白质。样品分子在氯化物和甘氨酸之间中间迁移,逐渐被压缩成非常薄而清晰的蛋白层,方便后面更好的蛋白分离。
在这个阶段,样本蛋白分子处于两种离子(后面的甘氨酸和前面的氯离子Cl-)之间,在浓缩胶和分离胶之间形成薄薄的一层。
当到达分离胶时,pH值增大,孔径急剧减小。在更高的pH值下,甘氨酸分子不再以两性离子的形式存在,它们在这个阶段就会电离,并开始比在浓缩胶中时迁移得更快。 氯离子Cl-很快就会向阳极迁移。 因此,一旦蛋白质不堆积,甘氨酸分子很快难以束缚样品蛋白质分子,蛋白质分子开始在电流的作用下按照分子量大小自由的分离。